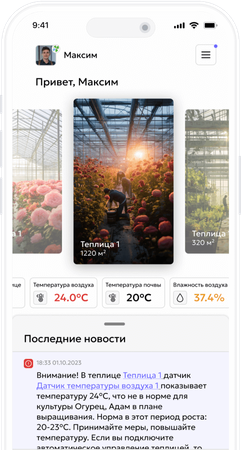
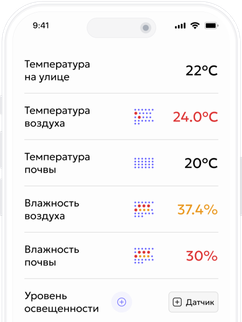
Кальций — ключевой элемент качества урожая, но в тепличных системах его часто «убивают» неправильным смешиванием удобрений. Стоит соединить кальциевую селитру с сульфатами или фосфатами — и в баке появляется осадок, который забивает фильтры и делает Ca недоступным для растения.
Проблема не в дозах, а в химии.
Кальций мгновенно реагирует с анионами SO₄²⁻ и PO₄³⁻, образуя гипс или фосфат кальция — оба нерастворимы. Чтобы этого избежать, важно знать совместимость солей и порядок растворения — иначе даже идеальный рецепт теряет смысл.

Химия на пальцах: почему кальций конфликтует
1. Что происходит на самом деле
Кальций (Ca²⁺) — сильный ион, который легко образует «пары» с любыми анионами.
Когда в том же баке появляются сульфаты (SO₄²⁻) или фосфаты (PO₄³⁻), ионы мгновенно связываются:
Ca²⁺ + SO₄²⁻ → CaSO₄ ↓
3Ca²⁺ + 2PO₄³⁻ → Ca₃(PO₄)₂ ↓
Оба соединения практически нерастворимы: CaSO₄ — около 0,2 г/100 мл воды, фосфат кальция — почти ноль. Даже небольшое пересечение концентраций вызывает кристаллизацию — осадок появляется, пока раствор ещё мешается.
2. Когда осадок выпадает быстрее
Температура.
При t > 25 °C скорость реакции растёт — летом осадок выпадает даже в слабых растворах.
pH воды.
При pH > 7,5 кальций частично переходит в карбонат (CaCO₃) — ещё один «враг» растворимости.
Без подкисления вода сама «вытягивает» кальций в осадок, даже без фосфатов.
Время и покой.
Даже если реакция незаметна сразу, в стоячем баке Ca связывается с остаточными SO₄²⁻ из скважинной воды. Через сутки появляется мутный налёт на стенках — потери кальция достигают 30–40 %.
3. Как это проявляется в теплице
– Мутный раствор и белый осадок в баке — кальций уже недоступен.
– EC падает без изменения рецепта — часть соли выпала.
– На растениях: вершинки томатов чернеют, листья теряют тургор, нарушается транспорт бора.
Именно поэтому кальциевые соли всегда держат отдельно, а порядок растворения подчиняют одной цели — не дать Ca встретиться с «врагами» раньше времени.
Мы подготовили целый материал о том, как рассчитать питательный раствор с разными составами самостоятельно — вы найдете его по ссылке.

Таблица несовместимости Ca-солей
1. Основные пары-конфликты
| Источник кальция | Несовместим с | Что происходит |
|---|---|---|
| Кальциевая селитра (Ca(NO₃)₂) | Сульфат магния, сульфат калия, сульфат аммония | Реакция с SO₄²⁻ → образуется гипс (CaSO₄↓). Белый осадок, засоры фильтров. |
| Кальциевая селитра | Монофосфат калия, суперфосфат, фосфорная кислота (в концентрате) | Ca₃(PO₄)₂↓ — нерастворимый осадок, кальций становится недоступным. |
| Кальциевая селитра | Сульфат железа, сульфат цинка, медный купорос | Мгновенно выпадают гидроксиды и сульфаты — раствор мутнеет. |
| Кальциевая селитра | Борная кислота, хелаты Fe-EDTA при pH > 6,5 | Нарушается стабильность хелатов, падает усвояемость микроэлементов. |
| Кальциевая селитра | Аммонийные соли при высоком pH | Сдвиг кислотности, частичное выпадение CaCO₃. |
2. Как читать таблицу
– Всё, где есть SO₄²⁻ или PO₄³⁻, — зона риска. Даже при малых дозах Ca выпадет в осадок.
– Если вещество содержит нитрат (NO₃⁻) — совместимо, реакция не идёт.
– С хелатами микроэлементов кальций не реагирует напрямую, но может разрушать хелат при высоком pH.
3. Практические выводы
«Бак А» — только для кальциевой селитры и железа.
Всё остальное — в «бак B»: фосфаты, сульфаты, микроэлементы. Если раствор мутнеет — это не «грязная вода», а неправильная комбинация ионов. Даже один неучтённый грамм фосфата в кальциевом контуре запускает осадкообразование.

Как собирать растворы: бак А и бак B
1. Логика разделения
Главное правило — кальций живёт отдельно.
Чтобы не допустить реакции с сульфатами и фосфатами, удобрения делят на два контура. Так кальций растворяется безопасно, а фосфаты и сульфаты остаются в своей зоне.
| Бак А | Бак B |
|---|---|
| Кальциевая селитра (Ca(NO₃)₂) | Калийная селитра (KNO₃) |
| Железо в хелате EDDHA или EDTA | Сульфат магния (MgSO₄·7H₂O) |
| (опционально) азотная кислота HNO₃ — для коррекции pH | Монофосфат калия (KH₂PO₄), сульфат калия (K₂SO₄) |
| Микроэлементы (B, Zn, Mn, Cu в хелатах) |
💡 Запомнить просто: всё, где есть Ca или Fe — в бак А; всё, где есть SO₄²⁻ или PO₄³⁻ — в бак B.
2. Практическое замечание
Даже если система автоматическая, человеческий фактор всё равно решает.
Ошибку часто вносит «добавка на глаз» — несколько грамм KH₂PO₄ в кальциевый бак.
Через день фильтры забиты, EC падает, и вся схема питания «плывёт».
Также мы детально разбирали тему ЕС раствора — заглядывайте, если еще не читали.
Кальций нельзя торопить — только строгая очередность и контроль воды.

Порядок растворения
1. Почему это важно
Даже совместимые соли можно «убить», если нарушить очередность.
Когда кристаллы попадают в концентрированный раствор, локально растёт pH и меняется химический баланс. Если кальций добавить не вовремя — он вступает в реакцию ещё до того, как раствор равномерно перемешан.
Поэтому порядок — это не формальность, а единственный способ сохранить раствор стабильным.
2. Правильная последовательность
1️⃣ Вода — ⅔ объёма бака.
Чистая, с температурой не ниже 15 °C. Сначала вода, потом соли.
2️⃣ Кальциевая селитра.
Всегда первая. Растворите полностью, без осадка на дне.
3️⃣ Азотнокислые соли (KNO₃, NH₄NO₃).
Добавляются после Ca(NO₃)₂, не вызывают конфликтов.
4️⃣ Сульфаты и фосфаты — только в другом баке (B).
Даже следы этих анионов в кальциевом контуре вызывают осадок.
5️⃣ Микроэлементы и кислоты — последними.
Сначала соли, потом корректировка pH. Кислоты в начале — частая ошибка, провоцирующая локальное осаждение кальция.
3. Контроль pH и EC
– Оптимальный pH раствора 5,5–6,5, иначе растворимость Ca резко падает.
– Если pH выше 7, добавьте небольшое количество HNO₃.
– Проверяйте EC после каждого компонента — скачок вниз сигнализирует, что часть соли выпала.
4. Типичные ошибки
– «Чтобы быстрее» — добавляют всё сразу. Осадок появляется мгновенно.
– Кислоту льют первой — рН падает локально, кальций связывается.
– Раствор не перемешивают — верх чистый, низ белёсый.
– Используют холодную воду — соли растворяются неравномерно, Ca кристаллизуется.
Порядок растворения — это страховка от осадка.
Пять минут лишнего времени при замесе — минус неделя прочистки системы.

Практические кейсы и «скрытые ловушки»
1. Фосфорная кислота — не всегда спасение
Многие добавляют фосфорную кислоту (H₃PO₄), чтобы понизить pH, но забывают: в концентрате она даёт PO₄³⁻, который мгновенно связывает Ca²⁺. Даже малая доза, внесённая прямо в кальциевый бак, вызывает осадок.
→ Решение: подкисляйте через общий контур, а не локально в «бак А».
2. Следы старого раствора
Даже если баки промыты, остатки фосфатных или сульфатных солей могут прилипать к стенкам и патрубкам. При следующем замесе кальциевый раствор взаимодействует с ними и мутнеет уже через несколько минут.
→ Решение: промывка не только водой, но и слабым раствором кислоты раз в неделю решает проблему.
3. Магний из фильтра
Некоторые используют магниевые засыпки (MgO) в системах фильтрации. Они выделяют Mg²⁺ и SO₄²⁻ при контакте с кислотой — а это идеальный рецепт для осадка CaSO₄.
→ Решение: если вода проходит через такой фильтр, Ca лучше вносить после точки разбавления.
4. «Тёплые баки» и ночное охлаждение
Днём температура в техпомещении поднимается до 30–35 °C, а ночью опускается до 15 °C. Такие колебания вызывают «внутреннее пересыщение» — раствор теряет равновесие, и Ca кристаллизуется при остывании.
→ Решение: держите баки в тени, исключите прямое солнце и перепады.
5. Хлориды и остатки дезинфекции
После санитарной промывки в воде могут оставаться Cl⁻ и остаточный NaOCl. Они не дают осадка, но повышают ионную силу раствора — кальций перестаёт растворяться полностью, остаётся «плавающий налёт».
→ Решение: после дезинфекции обязательно промойте систему чистой водой до нейтрального EC.
Вывод: даже идеально подобранная схема не спасёт, если Ca контактирует с остатками, кислотами или нагревом. Кальций «живой» — реагирует на мелочи, которые не видны в рецептуре, но решают всё в практике.

Таблица растворимости и критические точки
1. Почему важно знать растворимость
Растворимость — это граница, за которой начинается осадок.
Если концентрация соли превышает этот предел, даже при идеальном pH она начнёт выпадать кристаллами. Для тепличников это не теоретическая цифра — это ориентир, сколько можно положить в бак без риска «убить» раствор.
2. Растворимость основных солей при 20 °C
| Вещество | Растворимость, г/100 мл воды | Комментарий |
|---|---|---|
| Ca(NO₃)₂ — кальциевая селитра | ≈ 129 | Отлично растворима, безопасна при умеренной температуре. |
| CaSO₄ — сульфат кальция (гипс) | ≈ 0,2 | Практически не растворим, осадок образуется мгновенно. |
| Ca₃(PO₄)₂ — фосфат кальция | ≈ 0,002 | Почти нулевая растворимость — любое пересечение с PO₄³⁻ фатально. |
| KNO₃ — калийная селитра | ≈ 31 | Растворима, совместима с Ca. |
| MgSO₄·7H₂O — сульфат магния | ≈ 35 | Растворим, но несовместим с Ca в концентрате. |
| KH₂PO₄ — монофосфат калия | ≈ 23 | Растворим, но «враг» кальция. |
| CaCO₃ — карбонат кальция | ≈ 0,001 | Не растворяется — именно он образуется при высоком pH. |
3. Как читать эту таблицу
– Чем меньше цифра, тем больше риск осадка при контакте с кальцием.
– Значения даны для 20 °C — при 30 °C растворимость растёт на 5–10 %, но реакция идёт быстрее, и баланс всё равно теряется.
– При понижении температуры ниже 10 °C растворимость падает в разы — Ca(NO₃)₂ может «засахариться» даже в чистом виде.
4. Практический ориентир
| Условия | Что происходит | Что делать |
|---|---|---|
| Вода < 15 °C | Растворимость Ca падает | Подогреть воду, удлинить перемешивание |
| Вода > 30 °C | Растворимость выше, но риск осадка тоже | Удерживать 20–25 °C, избегать перегрева |
| pH > 7,5 | Образуется CaCO₃ | Подкислить воду до pH ≈ 6 |
| Длительное хранение раствора | Медленное выпадение осадка | Готовить свежие маточные растворы раз в 5–7 дней |
Главная мысль:
кальций растворяется только в узком диапазоне условий — умеренная температура, слабокислый pH и отсутствие «врагов» в баке. Нарушишь одно — и кристаллы появятся даже без лишних примесей.

Как тепличники решают это на практике
1. Разделение по бакам — не теория, а привычка
В профессиональных теплицах разделение «А» и «B» давно стало автоматикой. Схема проста: кальций и железо — отдельно, всё остальное — в другой контур.
Но главное не просто «разделить», а сохранять стабильность каждого бака: проверять pH, промывать линии, не переливать концентраты между ними «на глаз».
2. Автоматические системы дозирования
Современные дозаторы (Fertikit, Mixrite, Dosatron) не просто смешивают растворы,
а контролируют EC и pH в реальном времени. Если показания выходят за пределы — система подаёт сигнал: либо пошёл осадок, либо раствор теряет концентрацию.
В хороших системах есть даже «антиосадочная логика» — кальциевый канал автоматически промывается водой перед переключением на фосфатный.
3. Контроль фильтров и визуальных признаков
Фильтры — лучший индикатор ошибок.
Белый налёт — значит, CaSO₄ или CaCO₃; бурый — Fe(OH)₃, если pH был слишком высоким. Проверка раз в неделю — и вы видите, где в схеме начался конфликт.
Многие тепличники ставят прозрачные колбы, чтобы видеть состояние фильтра прямо на линии.
4. Промывки и профилактика
– Раз в 7–10 дней — техническая промывка чистой водой, чтобы удалить остатки осадка.
– Раз в месяц — слабокислая промывка (pH 4,5–5,0) для растворения гипсовых и карбонатных налётов.
– После работы с фосфатными растворами — обязательно промывать контур перед включением кальция.
5. Хранение и срок жизни раствора
Маточные растворы с Ca держат максимум 5–7 дней. Дольше — начинается естественная кристаллизация, даже при хорошем pH.
Раствор не мутный — не значит стабильный: через 3–4 дня кальций может оседать микрокристаллами без видимых признаков.
Главный вывод:
у опытных тепличников не бывает «случайного осадка» — всё под контролем: баки разделены, pH проверен, фильтры прозрачные. А кальций остаётся в работе, а не на дне бака.
Ранее мы писали, где питание теряется зимой — в баке, по пути или в субстрате — и что реально помогает вернуть усвоение. Читайте по ссылке.

Заключение
Кальций — элемент, который требует дисциплины. Он не прощает спешки, случайных добавок и экспериментов в баке. Стоит нарушить порядок или смешать с «врагами» — и половина удобрения превращается в осадок.
Вся логика проста: вода, температура, pH и очередность. Если эти четыре параметра под контролем — кальций работает безупречно. Если нет — он оседает, а система питания постепенно «глохнет».
Поэтому у опытных тепличников кальций живёт по своим правилам: отдельный бак, спокойный замес, контроль EC и прозрачные фильтры. Именно эта внимательность делает питание стабильным, а урожай — предсказуемым.